2024年3月,卢玺峰教授团队合作在国际知名期刊《Theranostics》(影响因子12,中科院JCR分区1区,TOP期刊),在线发表题为“Myocardin reverses insulin resistance and ameliorates cardiomyopathy by increasing IRS-1 expression in a murine model of lipodystrophy caused by adipose deficiency of vacuolar H+-ATPase V0d1 subunit”的研究论文,该研究以自发心肌肥大的Atp6v0d1脂肪敲除小鼠为背景,发现在心脏Myocardin显著减少小鼠心脏的脂质累积,并有效增强小鼠心脏的收缩和舒张功能。
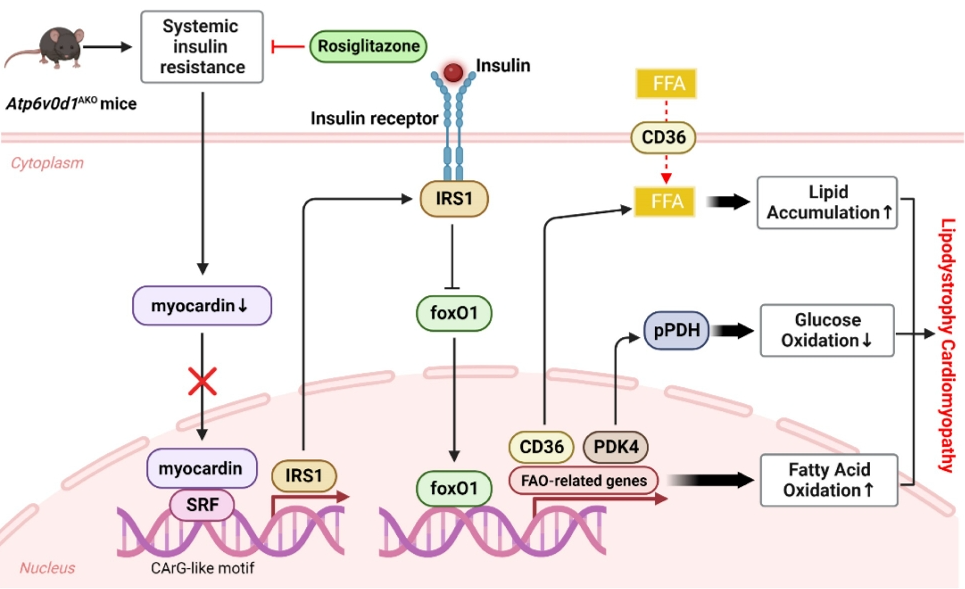
团队前期研究表明,Atp6v0d1脂肪敲除(Atp6v0d1AKO)小鼠出现显著的脂肪重量减少、肝脂肪变性以及机体糖代谢的紊乱。值得注意的是,Atp6v0d1AKO小鼠的心脏组织脂质过度蓄积,12周龄时发生自发性的心肌肥大,28周龄时则进展为心衰。综合以上表型,与现有的广泛应用于脂肪代谢障碍性心肌病的Bscl2-/-小鼠相似,但Bscl2-/-小鼠无法避免Bscl2基因本身对心脏功能的影响,因此Atp6v0d1AKO小鼠是一种新型的代谢障碍性心肌病的疾病动物模型。
对照小鼠与Atp6v0d1AKO小鼠心脏组织进行RNA-seq测序和分析后发现,Atp6v0d1AKO小鼠心脏组织脂肪酸氧化相关基因表达上调,同时葡萄糖氧化过程受到抑制以及胰岛素抵抗。Myocardin作为维持心脏功能稳态的重要转录因子,能够与血浆应答因子互作,识别CArG样元件,调控多种基因的表达。而Myocardin在Atp6v0d1AKO小鼠心脏组织中表达显著降低,提示Myocardin可能在该疾病的发病进程中发挥重要作用。研究中发现,Myocardin可以在转录水平调控胰岛素受体底物1(IRS1)的表达,Atp6v0d1AKO小鼠心脏特异性过表达Myocardin后,显著回复了该模型小鼠的心脏收缩功能、脂肪酸代谢水平以及IRS1介导的胰岛素信号转导通路,缓解了Atp6v0d1AKO小鼠的心肌肥大。
综上,本研究报道了一个新的脂肪发育障碍性心肌病的疾病模型,为该疾病发病机制的研究提供了新途径。另外,本研究揭示了Myocardin在心脏组织中调控心脏胰岛素抵抗和脂质代谢稳态的关键作用,为代谢型心肌病的治疗提供潜在的治疗策略和靶点。

通知类别:学术科研 撰稿人:药学学科 审核人:科研处








